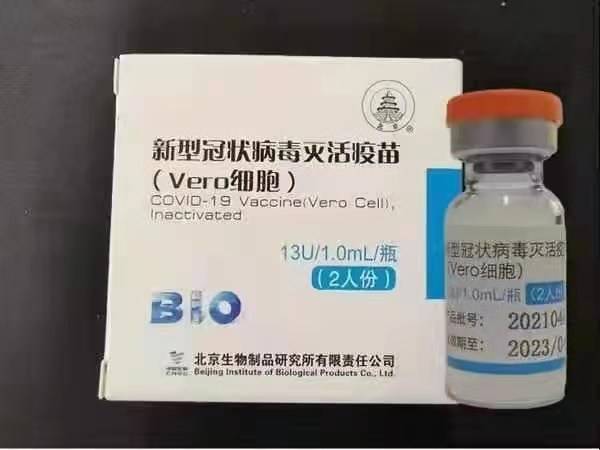
Sinopharm (Pekin): BBIBP-CorV
FAZA 1
1 próba
ChiCTR2000032459
Chiny
FAZA 2
2 Próby
NCT04962906
Argentyna
ChiCTR2000032459
Chiny
FAZA 3
6 prób
NCT04984408
ChiCTR2000034780
Zjednoczone Emiraty Arabskie
NCT04612972
Peru
NCT04510207
Bahrajn, Egipt, Jordania, Zjednoczone Emiraty Arabskie
NCT04560881, BIBP2020003AR
Argentyna
NCT04917523
Zjednoczone Emiraty Arabskie
Zatwierdzenia
Lista zastosowań awaryjnych WHO 59 krajów
Angola, Argentyna, Bahrajn, Bangladesz, Białoruś, Belize, Boliwia (wielonarodowe państwo), Brazylia, Brunei Darussalam, Kambodża, Kamerun, Czad, Chiny, Komory, Egipt, Gwinea Równikowa, Gabon, Gambia, Gruzja, Guynana, 、Iran (Islamska Republika) 、Irak 、Jordania 、Kirgistan 、Laotańska Republika Ludowo-Demokratyczna
Liban, Malezja, Malediwy, Mauretania, Auritius, Mongolia, Czarnogóra, Maroko, Mozambik, Namibia, Nepal, Niger, Macedonia Północna, Pakistan, Paragwaj, Peru, Filipiny, Republika Konga, Enegal, Serbia, Seszele, Sierra Wyspy, Somalia, Sri Lanka, Tajlandia, Trynidad i Tobago, Tunezja, Zjednoczone Emiraty Arabskie, Wenezuela (Republika Boliwariańska), Wietnam, Zimbabwe
Sinopharm BBIBP-CorV COVID-19 to inaktywowana szczepionka wykonana z wyhodowanych w kulturze cząstek wirusa, które nie mają zdolności patogennych. Ten kandydat na szczepionkę został opracowany przez Sinopharm Holdings i Pekiński Instytut Produktów Biologicznych.
Szczepionka Sinopharm BBIBP-CorV działa poprzez umożliwienie układowi odpornościowemu wytwarzania przeciwciał przeciwko koronawirusowi SARS-CoV-2 beta. Inaktywowane szczepionki wirusowe są stosowane od dziesięcioleci, takie jak szczepionka przeciwko wściekliźnie i szczepionka przeciwko wirusowemu zapaleniu wątroby typu A. Ta technologia rozwoju została z powodzeniem zastosowana do wielu dobrze znanych szczepionek, takich jak szczepionka przeciwko wściekliźnie.
Szczep SARS-CoV-2 firmy Sinopharm (szczep WIV04 i numer biblioteki MN996528) wyizolowano od pacjenta ze szpitala Jinyintan w Wuhan, Chiny. Wirus namnażano w hodowli w kompetentnej linii komórkowej Vero, a supernatant zakażonych komórek inaktywowano β-propiolaktonem (1:4000 obj./obj., 2 do 8°C) przez 48 godzin. Po oczyszczeniu resztek komórek i ultrafiltracji przeprowadzono drugą inaktywację β-propiolaktonem w takich samych warunkach jak pierwsza inaktywacja. Według WHO szczepionka została zaadsorbowana na 0,5 mg ałunu i załadowana do napełnionych strzykawek w 0,5 ml sterylnej soli fizjologicznej buforowanej fosforanami bez konserwantów.
31 grudnia 2020 r. Państwowa Agencja Leków ogłosiła zatwierdzenie eksperymentalnej szczepionki opracowanej przez Sinopharm.
7 maja 2021 r. Światowa Organizacja Zdrowia ogłosiła zatwierdzenie szczepionki. Lista zastosowań awaryjnych WHO umożliwiła krajom przyspieszenie ich własnych zezwoleń regulacyjnych na import i podawanie szczepionki przeciw COVID-19. Doradcza Grupa Ekspertów WHO ds. Strategii Szczepień również zakończyła przegląd szczepionki. Na podstawie wszystkich dostępnych dowodów WHO zaleca dwie dawki szczepionki w odstępie 3-4 tygodni dla osób dorosłych w wieku 18 lat i starszych. Skuteczność szczepionki przeciwko chorobie objawowej i hospitalizowanej szacuje się na 79% dla wszystkich grup wiekowych łącznie.
Amerykańskie Stowarzyszenie Medyczne opublikowało „A Randomized Clinical Trial: Effect of 2 Inactivated SARS-CoV-2 Vaccines on Symptomatic COVID-19 Infection in Adults” w dniu 26 maja 2021 r., stwierdzając, że „w tej wstępnie określonej analizie wstępnej randomizowanego badania klinicznego, dorośli Dwie inaktywowane szczepionki SARS-CoV-2 podane w tej wstępnie określonej wstępnej analizie randomizowanych badań klinicznych znacznie zmniejszyły ryzyko objawowego COVID-19, a poważne zdarzenia niepożądane występowały rzadko”. W tym randomizowanym badaniu III fazy z udziałem dorosłych skuteczność 2 inaktywowanych szczepionek zawierających całe wirusy w objawowych przypadkach COVID-19 wyniosła odpowiednio 72,8% i 78,1%. Dwie szczepionki miały rzadkie poważne zdarzenia niepożądane o podobnej częstości jak w grupie kontrolnej zawierającej tylko ałunu, a większość nie była związana ze szczepieniem. Analiza eksploracyjna wykazała, że 2 szczepionki indukowały mierzalne przeciwciała neutralizujące, podobnie jak wyniki badania fazy 1/2.
Grupa Robocza WHO SAGE opublikowała recenzję szczepionki Sinopharm / BBIBP COVID-19 10 maja 2021 r. Szczepionka COVID-19 firmy GAVI zawiera monitor fiolki ze szczepionką, który informuje pracowników służby zdrowia, czy szczepionka była właściwie przechowywana i nie była narażona na działanie przegrzanie. W rezultacie uszkodzenia, jak poinformował GAVI 14 maja 2021 r. Inteligentne etykiety wyprodukowane przez Zebra Technologies i wykonane przez Temptime Corporation składają się z okręgu z jaśniejszym kwadratem pośrodku, wykonane z bezbarwnej substancji chemicznej, która z czasem nieodwracalnie zmienia kolor . To staje się ciemniejsze, aby dać wizualne wskazanie skumulowanej ekspozycji na ciepło. Po wystawieniu fiolki na działanie ciepła przekraczającego optymalny zakres przechowywania, kwadrat staje się ciemniejszy niż okrąg, co wskazuje, że szczepionki nie należy już używać.
Numer rejestracyjny biblioteki leków szczepionki National Drug BBIBP-CorV COVID-19: DB15807.